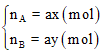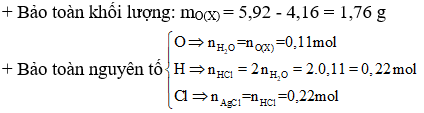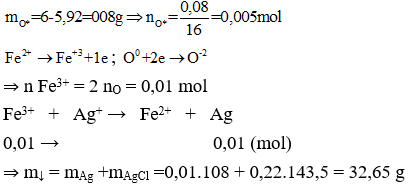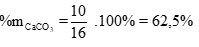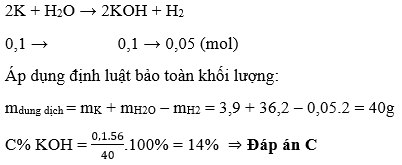1. Phương pháp bảo toàn nguyên tố:
1. Nội dung
Tổng số mol nguyên tử của một nguyên tố X bất kỳ trước và sau phản ứng là luôn bằng nhau
2. Phạm vi sử dụng
Trong các phản ứng hóa học các nguyên tố luôn được bảo toàn
⇒ Số mol nguyên tử của một nguyên tố X bất kì trước và sau phản ứng bằng nhau
Hầu hết tất cả các dạng bài tập đều có thể sử dụng phương pháp bảo toàn nguyên tố, đặc biệt là các dạng bài hỗn hợp nhiều chất, xảy ra biến đổi phức tạp. Thường sử dụng trong các trường hợp sau:
+ Từ nhiều chất ban đầu tạo thành sản phẩm
Từ dữ kiện đề bài ⇒ số mol của nguyên tố X trong các chất ban đầu ⇒ tổng số mol trong sản phẩm ⇒ số mol sản phẩm
+ Từ một chất ban đầu tạo thành hỗn hợp nhiều sản phẩm
Từ dữ kiện đề bài ⇒ Tổng số mol ban đầu, số mol của các hợp phần đã cho ⇒ số mol chất cần xác định
+ Từ nhiều chất ban đầu tạo thành nhiều sản phẩm
Đối với dạng bài này không cần thiết phải tìm chính xác số mol của từng chất, chỉ quan tâm: 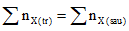
+ Đốt cháy để phân tích thành phần nguyên tố của hợp chất
Chú ý:
+ Hạn chế viết phương trình phản ứng mà viết sơ đồ phản ứng biểu diễn sự biến đổi của nguyên tố đang cần quan tâm
+ Từ số mol của nguyên tố chúng ta quan tâm sẽ tính ra được số mol của các chất
+ Số mol nguyên tố trong hợp chất bằng số nguyên tử của nguyên tố đó trong hợp chất nhân với số mol hợp chất chứa nguyên tố đó
Giả sử ta có hợp chất AxBy có số mol là a (mol).
Khi đó số mol nguyên tố A và B trong hợp chất là:
Bài tập ví dụ:
Ví dụ 1: Đốt cháy 4,16 gam hỗn hợp Mg và Fe trong khí O2, thu được 5,92 gam hỗn hợp X chỉ gồm các oxit. Hòa tan hoàn toàn X trong dung dịch HCl vừa đủ, thu được dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 6 gam chất rắn. Mặt khác cho Y tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
Giải:
+ Tương tự như trên ta cần phải tính được nAg, nung Z thu được oxit có m = 6g > mX(5,92g)
⇒ Trong X phải có FeO,
Do đó khối lượng O dùng để oxi hóa Fe2+ trong X thành Fe3+ là:
⇒ Đáp án A
Ví dụ 2: Hấp thụ hoàn toàn 2,24 lít (đktc) CO2 vào 100ml dung dịch gồm K2CO3 0,2 M và KOH x mol/lít. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư được 11,82 gam kết tủa. Giá trị X là:
Giải
2. Phương pháp bảo toàn khối lượng:
1. Nội dung
mtham gia = msản phẩm
Đối với bài toán sử dụng các chất dư sau phản ứng ta có:
mtrước pư = msau pư
Chú ý: Đối với các phản ứng tạo thành chất kết tủa, bay hơi, khối lượng dung dịch sẽ thay đổi sau phản ứng:
mdd sau phản ứng = mdd trước phản ứng + mchất tan – mkết tủa – mbay hơi
2. Phạm vi sử dụng
Thường sử dụng phương pháp bảo toàn khối lượng trong các bài toán sau:
+ Biết tổng khối lượng chất ban đầu ( tham gia) tính khối lượng chất tạo thành sản phẩm hoặc ngược lại
+ Trong bài toán có n chất mà chúng ta biết khối lượng của (n-1) chất ta sẽ tính được khối lượng chất còn lại
+ Những bài toán ta không thể xác định được số mol do không biết được phân tử khối của các chất
Bài tập ví dụ:
Ví dụ 1: Nhiệt phân hoàn toàn m gam hỗn hợp X gồm CaCO3 và Na2CO3 thu được 11,6 gam chất rắn và 2,24 lít khí (đktc). Thành phần phần trăm khối lượng CaCO3 trong X là
Giải:
Áp dụng định luật bảo toàn khối lượng ta có:
mX = mc/rắn + mCO2= 11,6 + 0,1.44 = 16g
Vậy phần trăm khối lượng của CaCO3 trong hỗn hợp X là:
Chú ý: Với bài toán trên thường mắc các lỗi sai:
+ Na2CO3 không bị nhiệt phân nhưng lại viết phương trình nhiệt phân và tính số mol khí CO2 được sinh ra từ nhiệt phân muối Na2CO3 và chất rắn gồm CaO; Na2O
Ví dụ 2: Hòa tan hoàn toàn 3,9g kali vào 36,2 gam nước thu được dung dịch có nồng độ là:
Giải:
Chú ý:
Bài toán này thường mắc lỗi ở việc tính khối lượng dung dịch, quên không trừ đi khối lượng của khí H2 bay đi
Ví dụ 3: Hỗn hợp X gồm Fe, FeO và Fe2O3. Cho một luồng CO đi qua ống sứ đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64 gam chất rắn A trong ống sứ và 11,2 lít khí B (đktc) có tỉ khối so với H2 là 20,4. Tính giá trị m.
Giải:
Khí B gồm: COdư ( x mol) và CO2 (y mol)
nB = x + y = 0,5 mol (1)
MB = 20,4.2 = 40,8g ⇒ mB = 40,8.0,5 = 20,4g
⇒ 28x + 44y = 20,4g (2)
Từ (1)(2) ⇒ x = 0,1 mol; y = 0,4 mol
Ta có: nCO pư = nCO2 = 0,4 mol
Áp dụng định luật bảo toàn khối lượng:
mX + mCO = mA + mCO2
⇒ mCOX = mCOA + mCOCO2 - mCO2 = 64 + 0,4.44 – 0,4.28 = 70,4g
⇒ Đáp án C
Nếu không sử dụng định luật bảo toàn khối lượng để quy ra số mol CO2 và CO pư mà việc tính toán dựa trên đặt ẩn số mol của các oxit thì việc giải ra kết quả rất phức tạp và liên quan đến việc sử dụng toán học khá nhiều.
3. Phương pháp bảo toàn electron:
Trong phản ứng oxi hoá - khử, số mol electron mà chất khử cho bằng số mol electron mà chất oxi hoá nhận. ∑ne cho = ∑ne nhận
Sử dụng tính chất này để thiết lập các phương trình liên hệ, giải các bài toán theo phương pháp bảo toàn electron.
* Nguyên tắc
Viết 2 sơ đồ: sơ đồ chất khử nhường e- và sơ đồ chất oxi hoá nhận e-.
* Một số chú ý
- Chủ yếu áp dụng cho bài toán oxi hóa khử các chất vô cơ
- Có thể áp dụng bảo toàn electron cho một phương trình, nhiều phương trình hoặc toàn bộ quá trình.
- Xác định chính xác chất nhường và nhận electron. Nếu xét cho một quá trình, chỉ cần xác định trạng thái đầu và trạng thái cuối số oxi hóa của nguyên tố, thường không quan tâm đến trạng thái trung gian số oxi hóa của nguyên tố.
- Khi áp dụng PP bảo toàn electron thường sử dụng kèm các PP bảo toàn khác (bảo toàn khối lượng, bảo toàn nguyên tố).
- Khi cho KL tác dụng với dung dịch HNO3 và dung dịch sau phản ứng không chứa muối amoni: nNO3- = tổng số mol e nhường (hoặc nhận).
Bài tập ví dụ:
Ví dụ 1. Cho 15,8 gam KMnO4 tác dụng với dung dịch HCl đậm đặc. Thể tích khí clo thu được ở điều kiện tiêu chuẩn là:
A. 5,6 lít. B. 0,56 lít. C. 0,28 lít. D. 2,8 lít.
Hướng dẫn:
Ta có: Mn+7 nhường 5 e (Mn+2),Cl- thu 2.e (Cl2)
Áp dụng định luật bảo toàn e ta có :
5.nKMnO4 = 2.nCl2
⇒ nCl2 = 5/2 nKMnO4 =0.25 mol⇒ VCl2 = 0,25 . 22,4 = 0,56 lít
Ví dụ 2. Cho hỗn hợp chứa 0,05 mol Fe và 0,03 mol Al tác dụng với 100ml dd Y gồm AgNO3 và Cu(NO3)2 cùng nồng độ mol. Sau phản ứng được chất rắn Z gồm 3 kim loại. Cho Z tác dụng với dd HCl dư thu được 0,35mol khí.Nồng độ mol mỗi muối trong Y là?
Hướng dẫn:
3 kim loại trong chất rắn Z là Ag, Cu và Fe dư ⇒ Al và 2 muối trong Y hết
Z + HCl: